摘要
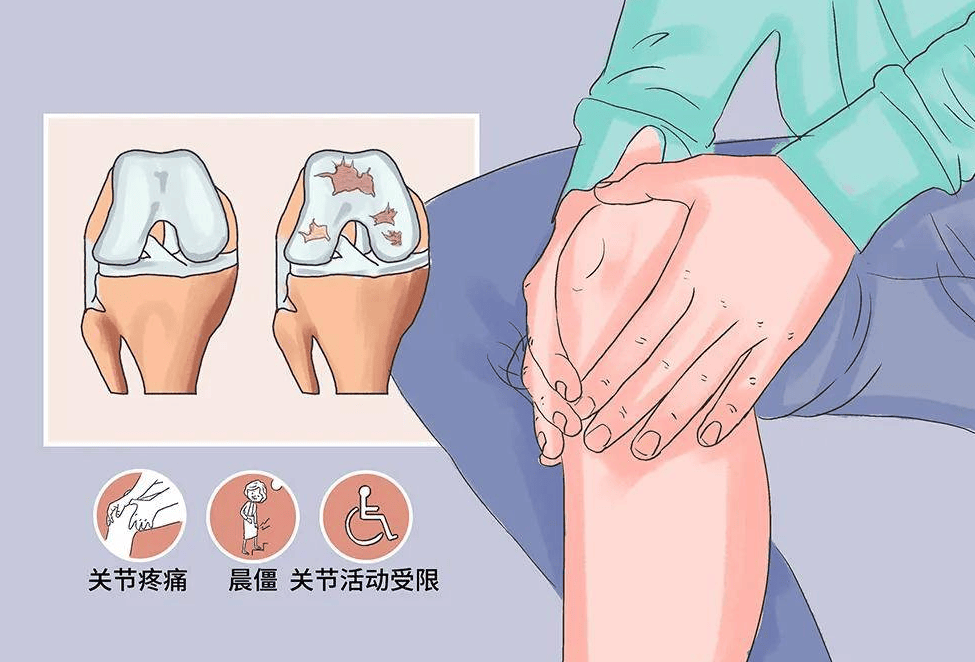
膝骨关节炎是中老年人群常见的退行性关节疾病,全球患病率持续上升,严重影响患者生活质量。传统治疗包括非甾体抗炎药、关节腔注射透明质酸、物理治疗等,主要针对症状缓解,无法逆转软骨损伤。间充质干细胞(MSCs)具有自我更新、多向分化潜能和免疫调节能力,为KOA的再生修复提供了新策略。近年来,多项临床研究证实MSCs治疗KOA的安全性和有效性,部分产品已进入III期临床试验阶段。
一、治疗方式
1.1 给药途径与方式
关节腔内注射是MSCs治疗KOA的主要给药方式。通常在超声或X线引导下,将MSCs悬液(细胞浓度通常为1×10⁶至1×10⁸个/mL)单次或多次注射入膝关节腔。注射后建议患者适当活动关节,使细胞均匀分布。部分研究采用联合注射策略,将MSCs与透明质酸、富血小板血浆(PRP)或生物支架材料混合后注射,以增强细胞存活和疗效。
1.2 剂量与疗程
目前尚无统一标准,常见方案包括:
l 单次注射:剂量范围1×10⁶至1×10⁸个细胞
l 多次注射:通常间隔3-6周,共2-4次
l 剂量效应:研究表明,中高剂量(≥5×10⁷个细胞)效果优于低剂量,但高剂量可能增加局部反应风险
二、作用机制
MSCs治疗KOA通过多重机制协同发挥作用,主要包括:
2.1 分化与组织修复
MSCs在特定微环境下可分化为软骨细胞,直接参与软骨缺损修复。体外实验证实,在TGF-β、BMP等因子诱导下,MSCs可表达II型胶原、蛋白聚糖等软骨特异性基质成分,形成软骨样组织。
2.2 旁分泌效应
这是MSCs发挥治疗作用的主要机制。MSCs通过分泌多种生物活性因子,包括:
l 生长因子:如TGF-β、IGF-1、FGF、VEGF等,促进软骨细胞增殖和基质合成
l 抗炎因子:如IL-10、IL-1RA,抑制炎症反应
l 外泌体:携带miRNA、蛋白质等,调节细胞间通讯,促进组织修复
2.3 免疫调节
MSCs通过多种途径调节免疫反应:
l 抑制促炎性T细胞(Th1、Th17)活化
l 促进调节性T细胞(Treg)生成
l 调节巨噬细胞极化(M1向M2转化)
l 降低炎症因子(TNF-α、IL-1β、IL-6)水平
2.4 其他机制
l 归巢效应:MSCs可定向迁移至损伤部位
l 抗氧化应激:提高SOD等抗氧化酶活性
l 抗纤维化:抑制TGF-β/Smad通路,减少病理性纤维化
l 改善微环境:促进血管生成,改善局部血供
三、 临床研究进展
3.1 疗效评估
多项随机对照试验(RCT)和荟萃分析证实了MSCs治疗KOA的有效性:
l 疼痛改善:VAS评分在治疗后3-6个月显著下降,改善率可达40%-60%。一项纳入8项RCT、502例患者的荟萃分析显示,MSCs组6个月时VAS评分显著优于对照组(P<0.05)。
l 功能改善:WOMAC评分、KOOS评分等关节功能指标在治疗后明显改善。重复注射组(2-4次)在12个月时功能改善率可达89%,显著优于单次注射组。
l 像学变化:部分研究通过MRI观察到软骨厚度增加、缺损面积缩小,但不同研究结果存在差异,可能与评估方法和随访时间有关。
3.2 安全性评估
现有临床研究显示,MSCs治疗KOA安全性良好。常见不良反应包括:
l 注射后短暂关节肿胀、疼痛(发生率约10%-30%)
l 轻度关节积液
l 短暂发热
这些反应多为自限性,通常在1周内自行缓解。无严重不良事件(如感染、肿瘤形成)罕见报道。最长7年随访研究未发现长期安全性问题。
间充质干细胞治疗膝骨关节炎展现出良好的临床应用前景。现有临床证据表明,关节腔内注射MSCs可有效改善KOA患者疼痛和功能,安全性良好。但当前研究仍存在异质性大、长期数据缺乏等问题。未来需通过大样本、多中心、长期随访研究,进一步明确最佳治疗方案、作用机制和长期安全性,推动这一创新疗法真正惠及患者。
参考文献
1.Cao M, Ou Z, Sheng R, et al. Efficacy and safety of mesenchymal stem cells in knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Stem Cell Research & Therapy. 2025;16(1):122. doi:10.1186/s13287-025-04252-2
2.Zhang L, Wang H, Chen X, et al. Contextual effects of mesenchymal stem cell injections for knee osteoarthritis: systematic review and meta-analysis of randomized controlled trials. Frontiers in Medicine. 2025;12:1636181. doi:10.3389/fmed.2025.1636181
3.Jo CH, Lee YG, Shin WH, et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof-of-concept clinical trial. Stem Cells. 2014;32(5):1254-1266. doi:10.1002/stem.1634
4.Matas J, Orrego M, Amenabar D, et al. Umbilical cord-derived mesenchymal stromal cells (MSCs) for knee osteoarthritis: repeated administration is superior to a single-dose MSCs in controlling symptoms and preventing cartilage degeneration in a long-term follow-up RCT. Cytotherapy. 2019;21(12):1249-1262. doi:10.1016/j.jcyt.2019.10.004
5.Wang AT, Feng Y, Jia HH, et al. Application of mesenchymal stem cell therapy for the treatment of osteoarthritis of the knee: a concise review. World Journal of Stem Cells. 2019;11(10):781-798. doi:10.4252/wjsc.v11.i10.781
6.Garcia J, Wright K, Hannon C, et al. Efficacy and safety of allogeneic adipose-derived mesenchymal stem cells for the treatment of knee osteoarthritis: a phase 3, randomized, double-blind, placebo-controlled trial. Annals of the Rheumatic Diseases. 2022;81(5):698-706. doi:10.1136/annrheumdis-2021-221129
7.中国骨关节炎诊疗指南编写组. 中国骨关节炎诊疗指南(2024版). 中华骨科杂志. 2024;44(1):1-20.
8.Qu H, Sun S. Efficacy of mesenchymal stromal cells for the treatment of knee osteoarthritis: a meta-analysis of randomized controlled trials. Journal of Orthopaedic Surgery and Research. 2021;16(1):11. doi:10.1186/s13018-020-02128-0
9.Kim YS, Suh DS, Tak DH, et al. Mesenchymal stem cell implantation in knee osteoarthritis: an assessment of the factors affecting clinical outcomes. The American Journal of Sports Medicine. 2021;49(10):2773-2780. doi:10.1177/03635465211023558
10.Zhao F, Zhang Y, Wang H, et al. Entering the era of living biopharmaceuticals for treating knee osteoarthritis: a systematic review and network meta-analysis. World Journal of Stem Cells. 2025;17(8):107076. doi:10.4252/wjsc.v17.i8.107076