摘要
阿尔茨海默病(Alzheimer's disease, AD)是一种进行性神经退行性疾病,目前缺乏有效治疗手段。干细胞移植为AD治疗提供了新的思路。本文基于文献计量学方法,运用CiteSpace软件对2003-2018年干细胞治疗AD的研究文献进行可视化分析,系统梳理了该领域的研究现状、热点演进及发展趋势。研究发现,研究主题围绕"AD—干细胞—移植—组织工程"主线展开,经历了从神经干细胞移植到间充质干细胞应用,再到组织工程与分化调控的发展历程。干细胞疗法通过多靶点干预AD病理过程,展现出良好的治疗前景。
1 研究背景与方法
1.1 研究背景
阿尔茨海默病是最常见的神经退行性疾病,以进行性认知功能障碍为主要特征,病理表现为β-淀粉样蛋白(Aβ)沉积、Tau蛋白过度磷酸化、神经炎症和神经元丢失。目前临床治疗以对症支持为主,缺乏有效逆转疾病进程的药物。干细胞移植通过细胞替代、旁分泌效应和免疫调节等多重机制,为AD治疗提供了新的策略。
1.2 研究方法
本研究采用文献计量学方法,检索中国知网(CNKI)、中国生物医学文献数据库(SinoMed)、ISI Web of Knowledge和Embace等数据库,以"阿尔茨海默病""干细胞"等为关键词,筛选相关文献。运用CiteSpace软件进行关键词聚类、时区图谱分析,揭示研究主题、演进路径及前沿趋势。
2 研究现状与热点分析
2.1 文献增长趋势AD研究文献数量呈逐年上升趋势,主要集中在神经病学、精神病学、临床医学和基础医学领域,相关研究持续增长,反映出该领域的研究热度不断提升。
2.2 研究主题聚类
通过关键词聚类分析,发现AD研究核心关键词包括:阿尔茨海默病(180次)、神经干细胞(69次)、移植(28次)、干细胞(16次)、骨髓间充质干细胞(14次)等。研究核心领域围绕"AD—干细胞—移植—组织工程"主线展开,聚焦于干细胞移植治疗机制、分化调控及组织工程应用。
3 研究演进路径
通过时区图谱分析,可将干细胞治疗AD的研究分为三个阶段:第一阶段(2003-2008年):以神经干细胞移植的动物实验为主,重点研究神经干细胞分化、迁移及对认知功能的改善。此阶段主要探索干细胞移植的可行性及初步疗效。第二阶段(2009-2015年):转向骨髓间充质干细胞、人脐带间充质干细胞的应用,关注Aβ蛋白清除及神经保护机制。研究重点从细胞替代转向旁分泌效应和免疫调节。第三阶段(2016-2018年):聚焦组织工程、细胞凋亡调控等新兴方向,但突破性进展有限。此阶段开始探索干细胞分化调控和精准治疗策略。
4 干细胞治疗的应用与机制
4.1 干细胞类型与作用
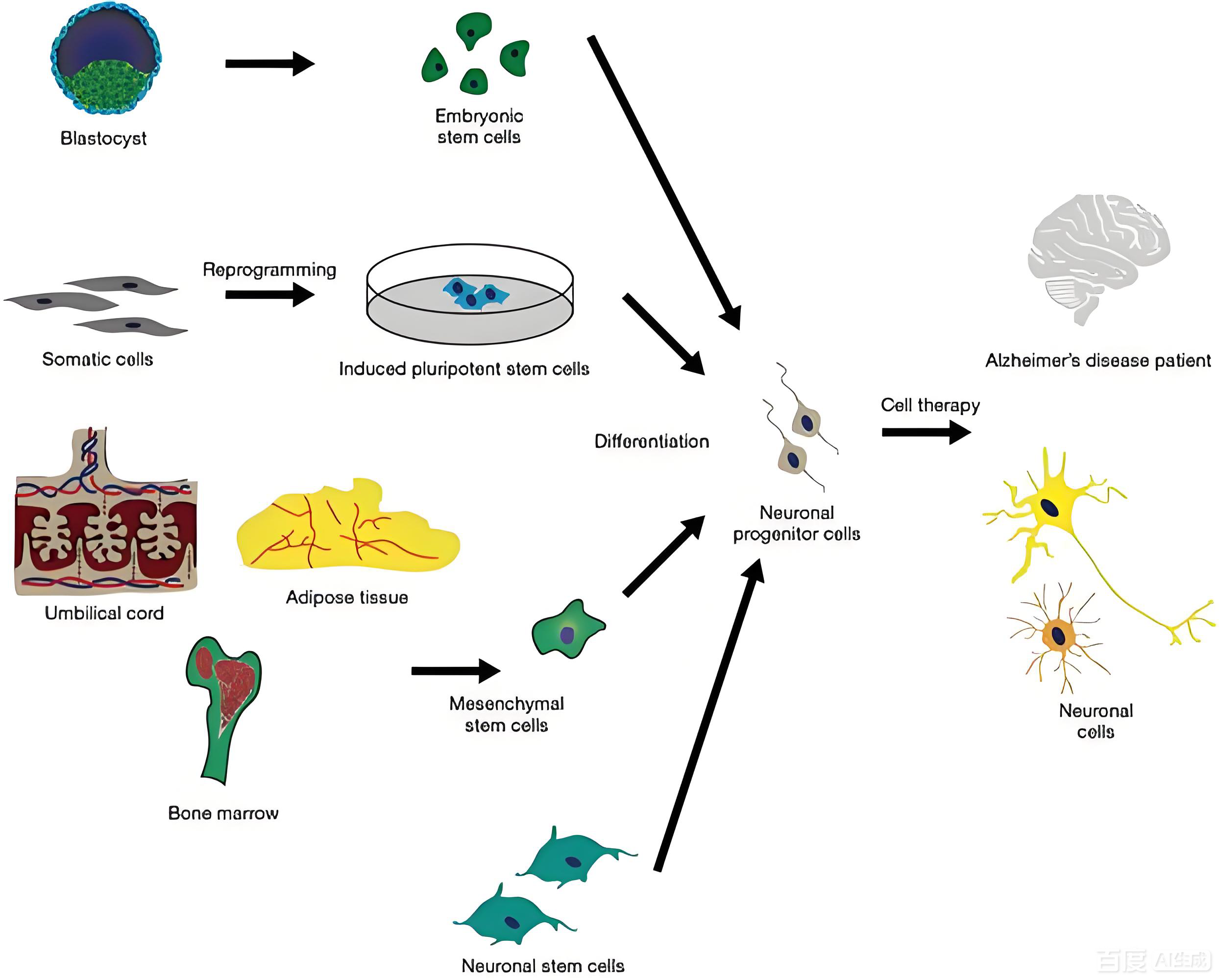
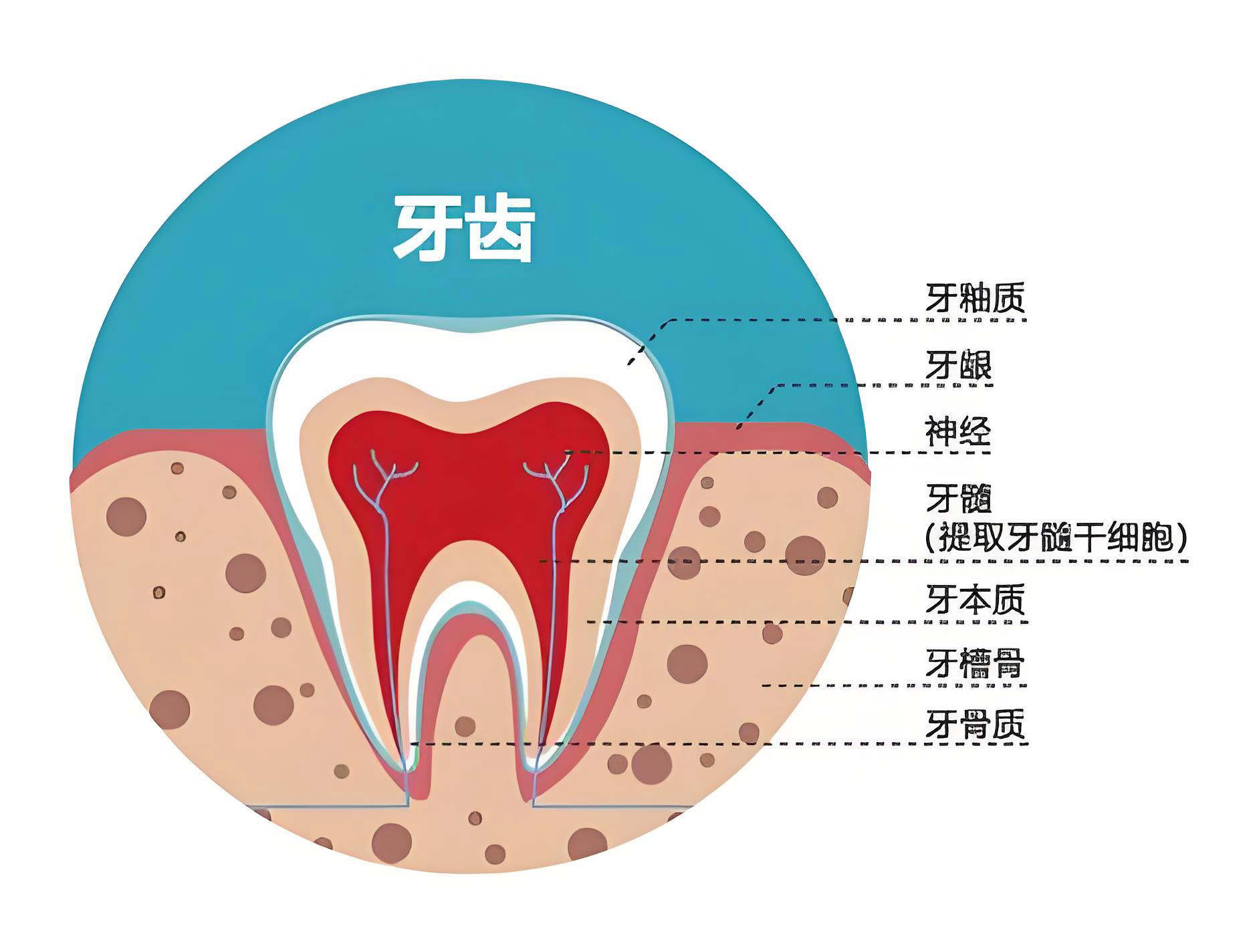
神经干细胞(NSCs):可通过内源性诱导或外源性移植促进神经再生,分泌脑源性神经营养因子(BDNF)改善认知功能。NSCs具有自我更新和多向分化潜能,可分化为神经元、星形胶质细胞和少突胶质细胞。胚胎干细胞(ESCs):多能性强,可分化为所有类型的神经细胞,但存在成瘤性、免疫排斥和伦理争议等问题,临床应用受限。间充质干细胞(MSCs):易获取、低免疫原性,可通过静脉注射穿透血脑屏障,发挥抗炎、促进Aβ清除及神经修复作用。MSCs来源广泛,包括骨髓、牙髓、脐带等组织。
4.2 治疗机制
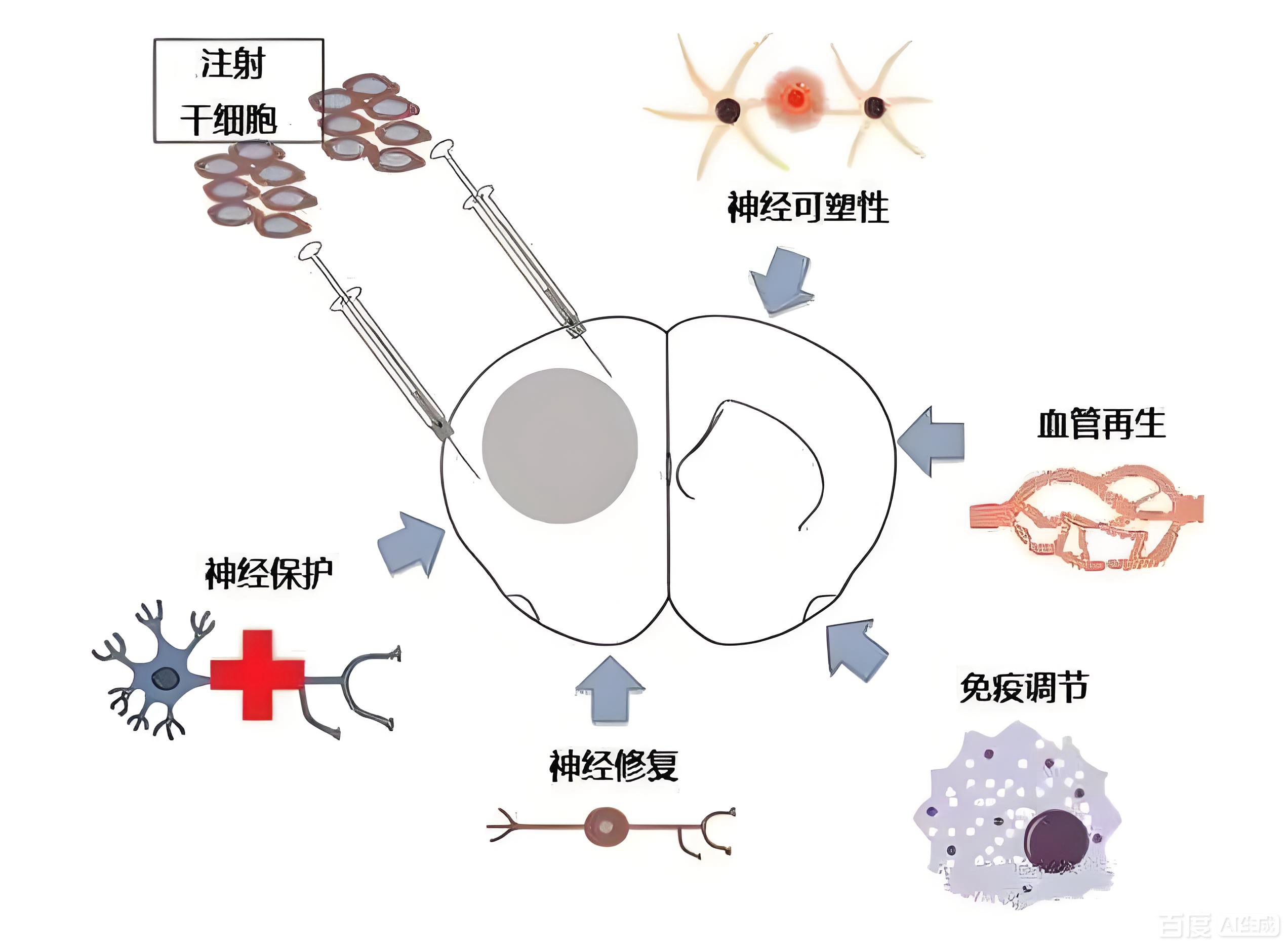
细胞替代与旁分泌效应:移植干细胞可分化为功能神经元,或通过分泌神经营养因子(如BDNF、VEGF、GDNF)刺激内源性神经干细胞增殖分化,促进突触形成和神经环路重建。
免疫调节:MSCs可调节小胶质细胞极化,促进其向抗炎的M2型转化,减轻神经炎症反应。同时,MSCs可抑制T细胞活化,降低促炎因子(TNF-α、IL-1β)表达。
分化调控:关键基因(如Nanog、Sox2、Oct4)和微环境因子(如分泌型APP、神经营养因子)可定向诱导干细胞向神经细胞分化。组织工程支架可为干细胞提供三维生长环境,促进其存活和功能发挥。
5结论
干细胞治疗AD的研究主线清晰,围绕干细胞移植、组织工程等核心领域发展。通过文献计量学分析,揭示了该领域从基础研究向临床转化的发展趋势。通过多学科交叉和创新技术(如基因调控、旁分泌机制应用),干细胞疗法有望为AD患者提供新的治疗策略。未来研究应聚焦分化机制、安全性评估和临床转化,推动干细胞治疗从实验室走向临床。
参考文献: 干细胞治疗阿尔茨海默病的研究进展与趋势分析[J]. 中国组织工程研究, 2019, 23(1): 1-8.